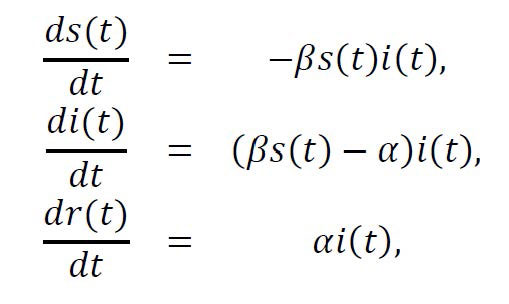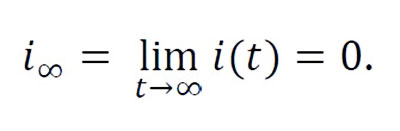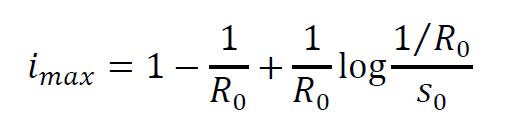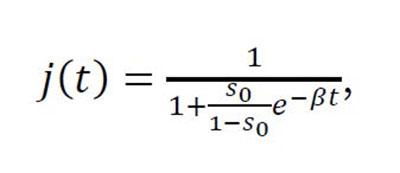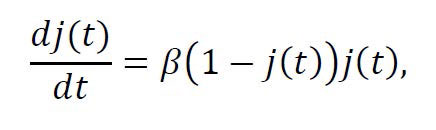|
por Mario Castro Ponce, Manuel de León y Antonio Gómez Corral 28 Marzo 2020 del Sitio Web Madri+d
No se conoce la naturaleza de la plaga, pero según el historiador Tucídides, que la contrajo y sobrevivió, la ciudad de Pericles tardó 50 años en recuperarse y, durante esa época, la desesperanza fue tal que sus habitantes perdieron la fe en los dioses y en las leyes ante una inminente muerte.
Según Tucídides, la plaga vino de Etiopía y pasó luego a Egipto, Libia y Grecia.
Incluso los
espartanos que asediaban Atenas se retiraron por el temor a la
epidemia.
Otro episodio terrible está asociado a la mal llamada gripe española de 1918, que acabó con 25 millones de vidas en todo el mundo en sus primeros seis meses (aunque algunas fuentes llegan hasta los 100 millones en total).
Estudios recientes han
identificado el virus causante como un
virus aviar.
Hemos temblado con las noticias de pandemias causadas por virus de animales, como el SARS (murciélagos en China) y el MERS (murciélagos en Arabia Saudí).
Estos dos últimos casos
son producidos por coronavirus; es decir, virus que padecen algunos
animales y que, en algún momento, sufren una mutación que les
permite atacar también a los humanos (a veces por una especie
intermedia).
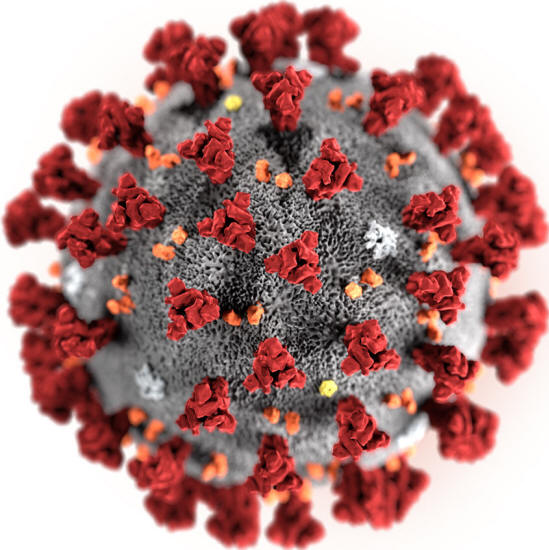
Aunque el SARS-nCoV-2 (inicial y comúnmente conocido como Covid-19) es un nuevo virus y nos pone ante un nuevo desafío, no resulta totalmente desconocido por pertenecer a la familia de los coronavirus (Figura 1).
No obstante, la pandemia
que ha generado no sólo tiene que ver con los aspectos biológicos
del virus sino, quizá con mayor importancia, con aspectos sociales y
demográficos.
Coronavirus y sus características espínulas
en
forma de corona.
En ocasiones, las matemáticas ayudan modestamente a comunicar mejor o incluso a simular escenarios que ayuden a la toma de decisiones.
Las herramientas que están más cercanas a estos problemas son,
...y en general el análisis de datos, juegan ya un papel relevante, especialmente cuando queremos incluir los aspectos de las conductas sociales.
Para probar al lector que esto no es así, seamos osados y ¡contemos con los dedos! Imaginemos que cuando acabe todo fuésemos capaces de determinar quién contagió a quién.
El lector podría ser el primer portador del virus y haber estrechado la mano o tosido delante de otras 3 personas que se contagiaron a su vez.
Luego, cada una de estas tres personas habrían contagiado a otras 3 (y ya van 1+3+9) que, por avatares de la vida, habrían propagado la infección a otras 3 (es fácil contar: 1+3+9+27).
Por poner unos ejemplos,
Con R0 no somos capaces de medir cómo de letal es un virus, sólo cómo de infeccioso ha sido en una cierta población.
A partir de los datos de
China, se observa que SARS-CoV-2 tiene un factor-estimado en
R0
2,68
(aunque sospechamos que, en el caso de Italia o España,
R0
podría ser
mayor).
Para cuantificar este impacto, proponemos utilizar un modelo matemático (y sus variantes) ya existente propuesto por el escocés Anderson Gray McKendrick en el año 1926, conocido como modelo SIR de epidemias.
Con los términos SIR se hace énfasis sobre los tres estados de un individuo ante la enfermedad:
...así como su evolución S -> I -> R en el tiempo.
Los estados dan lugar a
tres compartimentos - o sub-poblaciones de individuos susceptibles,
infectados y removidos - que permiten clasificar a los individuos de
la población en cada instante de tiempo.
...respecto al tamaño N de la población (que se asume constante) dado por,
...donde β es la tasa de infección y α es la tasa de recuperación, en el supuesto de las proporciones iniciales s(0)= s0 >0, i(0)=1- s0 >0 y r(0)=0.
En lenguaje cotidiano, la primera ecuación nos dice que la velocidad con la que decrece el número de susceptibles es proporcional al producto s(t) i(t), donde este producto se puede interpretar como la probabilidad de que una persona susceptible se encuentre con una infectada y el parámetro β mide la probabilidad de que el contagio sea exitoso.
Es interesante entender que β tiene tanto que ver con el número promedio de “encuentros” entre personas susceptibles e infectadas, como con el resultado de esa infección. Como discutiremos más adelante, esto tiene implicaciones en las políticas de aislamiento y de higiene.
Una sencilla
interpretación de los signos de las derivadas de s(t), i(t) y
r(t), garantiza que la proporción de individuos susceptibles
disminuirá (s(t)≤ s0) hacia su valor final
s∞= lim t→∞ s(t) y la proporción de
removidos se incrementará hacia un valor final r∞=
lim t→∞ r(t) mientras que, en ambos casos, existan
individuos infectados. Por el contrario, la proporción de infectados
aumentará si βs(t)>α y disminuirá si βs(t)<α.
En este segundo caso, tiene sentido hablar de epidemia y el pico de la infección se alcanza cuando la proporción de susceptibles coincide con el umbral crítico α/β, es decir, en el instante de tiempo > 0 que verifica = 1/.
Como mencionamos con
anterioridad, el coronavirus SARS-CoV-2 tiene un valor de próximo a
2,68, por lo que si toda la población fuese susceptible al virus (esto
no sabemos si es así al día de hoy), el virus podría infectar
simultáneamente a casi un cuarto de la población si no aplicamos
alguna medida de precaución o control.
Para ello, basta traducir la capacidad del sistema sanitario en términos de un número i* que refleje sus limitaciones (por ejemplo, en términos de la proporción de camas hospitalarias en UCI disponibles para atender a una población de individuos), y concluir que los recursos son suficientes si se tiene imax ≤ i* o, por el contrario, son insuficientes cuando imax > i*.
Para complementar nuestros comentarios sobre R0 y la noción de velocidad exponencial de crecimiento de una epidemia, nos fijamos en la proporción j(t) = i(t) + r(t) de individuos afectados por la enfermedad hasta el instante t (si se estuviesen realizando tests masivamente en la población, esta proporción debería coincidir con los datos que aparecen en los medios asociada a los "casos confirmados").
A partir de esta proporción, podemos estimar el número acumulado de fallecidos, dado por ρNj(t), donde ρ es el índice de letalidad de la enfermedad.
En concreto, el valor ρ=0,023 estimado en China refleja que el porcentaje de fallecidos entre los afectados por SARS-CoV-2 es el 2,3%.
Matemáticamente, se puede encontrar una expresión explícita para la fracción de afectados:
Esta muestra que la proporción j(t) es inversamente proporcional
a e-βt,
de manera que el número acumulado de afectados Nj(t) se incrementará
a la misma velocidad que el valor de decrezca cuando el tiempo t se
incremente.
En concreto, existirá un intervalo de tiempo donde la velocidad del crecimiento de j(t) aumenta hasta alcanzar su valor máximo.
Para determinar ese intervalo, traducimos la velocidad de crecimiento de j(t) en términos de su derivada,
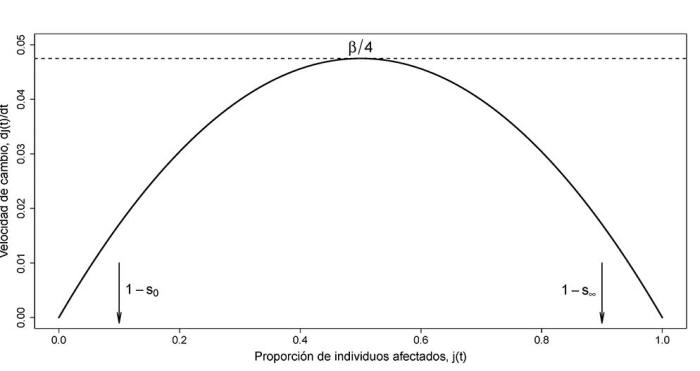
Desde la Figura 2 es
sencillo llegar a la conclusión de que la máxima velocidad de
crecimiento se alcanzará cuando j(t) = 1/2 y lo habrá hecho en un
instante de tiempo antes del cual la velocidad de crecimiento crece
hasta su valor máximo β/4 y, después del cual, la velocidad comienza
a decrecer progresivamente.
Figura 2: La velocidad de crecimiento
es decir, dj(t)/dt) como función de j(t).
La respuesta se encuentra
entre nuestras observaciones anteriores.
En este punto, toman
sentido las medidas de distanciamiento social, así como medidas
profilácticas (uso de guantes, mascarillas, lavado de manos)
dictadas por los Gobiernos de los países afectados por SARS-CoV-2.
En ese caso, la tasa de contagio estimada es β = 0,19 días -1 y el tiempo medio de transmisión es, aproximadamente, 1/β= 5,26 días.
Tomemos cuatro escenarios:
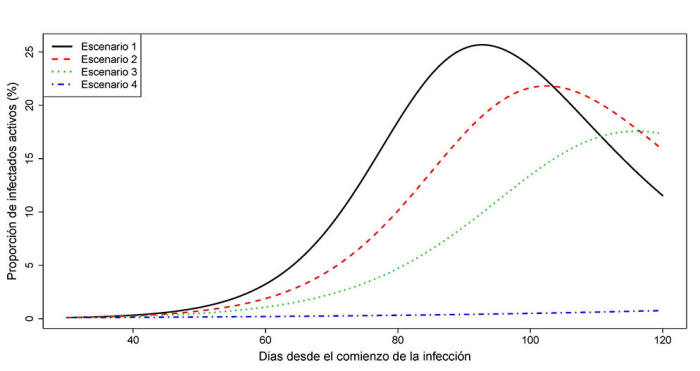
Variación de la proporción de infectados i(t)
en
función de la intensidad de las medidas de contingencia.
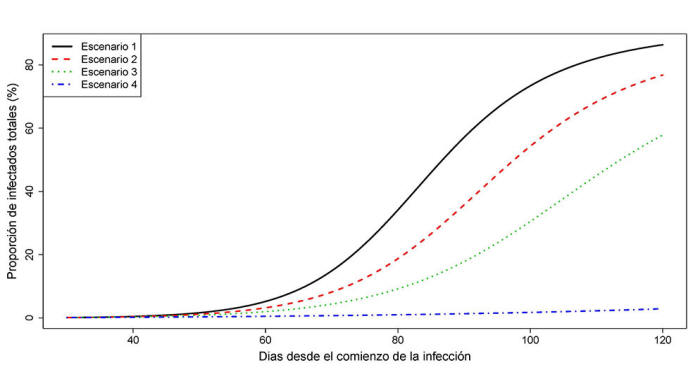
Variación de la proporción de individuos afectados j(t) en función de la intensidad de las medidas de contingencia.
Las matemáticas del coronavirus Covid-19
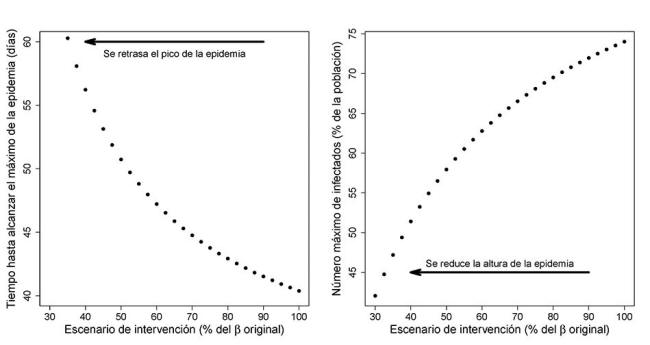
Tiempo transcurrido hasta alcanzar el pico de infección tmax y proporción máxima de individuos simultáneamente infectados imax en función de la intensidad de las medidas de contingencia.
En tal caso, una adecuada especificación del umbral i* de capacidad límite de los recursos sanitarios permitirá definir medidas de contingencia concretas, sin que resulten ser excesivas para los ciudadanos.
El incremento del número
de días desde el inicio de los contagios hasta alcanzar el pico de
infección también permite dar cabida al desarrollo de tratamientos
paliativos (antivirales) y acercarnos a la fecha en la que una
vacuna pueda estar disponible y ayude a poner fin definitivamente a
la epidemia.
Por ello, todos los esfuerzos de lucha frente a SARS-CoV-2 están orientados hacia la disminución de la tasa de contagio β.
NOTA: Lamentablemente, el modelo SIR se queda muy corto a la hora de modelar y predecir el futuro de esta epidemia ya que toma como hipótesis que no hay período de incubación, es decir, que alguien puede transmitir en cuanto está contagiado. Esto se sabe que no es cierto y de hecho la curva cambia radicalmente para un período de incubación de 2 días, mucho más para los 5,5 días que se calcula que es la media del período de incubación real. Sería muy interesante ver este mismo análisis pero usando este 'modelo SEIR' (ver 'Nowcasting and forecasting the potential domestic and international spread of the 2019-nCoV outbreak originating in Wuhan, China - A modelling study'). - Comentario de Carlos Rosety - 29 marzo 2020
Con seguridad, ambos estarán muy alejados de una realidad que, por ahora y hasta que la pandemia de SARS-CoV-2 se estabilice, no conoceremos con detalle...
En ese momento, las estimaciones de las tasas de contagio y de recuperación serán más precisas y el modelo se verá seriamente modificado por la necesidad o no de distinguir entre susceptibles, infectados-asintomáticos, infectados-sintomáticos, recuperados-infecciosos y recuperados (incluyendo a los fallecidos) si se confirman los diferentes indicios epidemiológicos en ese sentido.
Incluso el modelo podría ser estructurado por edades y patologías previas para reflejar diferentes niveles de letalidad de la enfermedad, e incluso modificado cuando una vacuna efectiva sea conocida.
Otros caminos no tan evidentes y que merecen ser explorados consistirían en asumir que los parámetros del modelo son cambiantes (debido a medidas políticas, al temor de los ciudadanos frente a las noticias...).
O, por poner otro ejemplo, la suposición de que el contagio es proporcional a s(t) i(t) debería modificarse para reflejar la compleja red social de contactos:
No nos cabe ninguna duda de que, para conseguir un modelo predictivo suficientemente preciso para el estudio de SARS-CoV-2, será necesario realizar un esfuerzo multidisplicinar entre epidemiólogos, inmunólogos, neumólogos, bioestadísticos y matemáticos, entre otros.
Desde
el lado de las
matemáticas y, en general, de
todas las ramas de la ciencia, ya
existen algunas iniciativas para desarrollar modelos más precisos
que permitan evaluar cuantitativamente el impacto de estas medidas.
|