|
por University of
Groningen
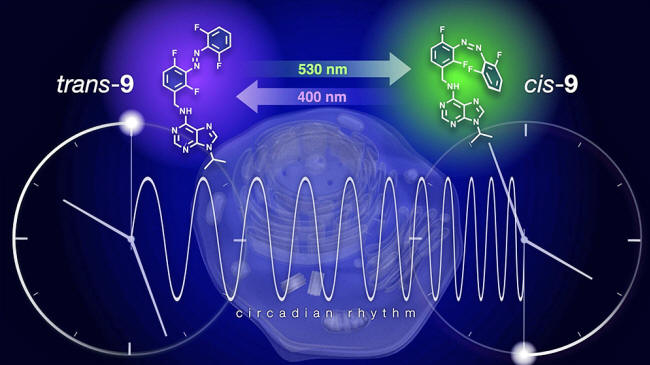
Modulación reversible del reloj circadiano mediante la cronofarmacología. Utilizando la luz para inter-convertir dos isómeros de una pequeña molécula fotosensible, es posible marcar el ritmo del tiempo celular. Mientras que la irradiación con luz violeta alarga el reloj normal de 24 horas a 28 horas, la luz verde desactiva este efecto y devuelve el reloj a la normalidad. © Ilustración Issey Takahashi
Las alteraciones de este ciclo, por ejemplo por trabajar en turnos de noche, pueden provocar enfermedades. En los últimos años ha quedado claro que el reloj puede alterarse en órganos o tejidos concretos.
Para estudiar y potencialmente curar los problemas de los relojes dentro de nuestras células, científicos holandeses y japoneses crearon un compuesto que alarga el ciclo de 24 horas y que puede activarse o desactivarse mediante la luz.
Tras la desactivación, las células y los tejidos volvieron a un ciclo casi normal.
El compuesto puede utilizarse para investigar los relojes del interior de nuestras células y, con el tiempo, puede servir para tratar enfermedades causadas por un reloj alterado.
A medida que surgen más y más pruebas de que los relojes de ciertos órganos podrían estar desincronizados, surge la necesidad de investigar y reajustar estos relojes localmente.
Científicos de los Países Bajos y Japón introdujeron un interruptor de encendido/apagado controlado por la luz en un inhibidor de quinasa, que afecta a la función del reloj.
Esto les permite controlar el reloj biológico en células cultivadas y tejido explantado.
Publicaron sus resultados el 26 de mayo en Nature Communications.
Nuestro reloj circadiano está regulado por un controlador central en el núcleo supraquiasmático, una región del cerebro situada directamente encima del nervio óptico, pero todas nuestras células contienen un reloj propio.
Estos relojes consisten
en una oscilación en la producción y descomposición de ciertas
proteínas.
Para estudiar estos efectos, sería útil disponer de un fármaco que afecte a los relojes y que pueda ser activado localmente.
Esto último es algo que ya han hecho los grupos de Wiktor Szymanski y Ben Feringa. Crearon varios compuestos, como antibióticos o fármacos contra el cáncer, que podían activarse y desactivarse con la luz.
Anteriormente, el biólogo circadiano Tsuyoshi Hirota, profesor asociado del Institute of Transformative Bio-Molecules de la Universidad de Nagoya (Japón), desarrolló un inhibidor de la quinasa, la longdaysin, que ralentiza el reloj circadiano hasta un ciclo que dura hasta 48 horas.
Kolarski dotó a esta
longdaysin de un interruptor de luz que le permitía activar o
desactivar el compuesto con luz violeta y verde, respectivamente.
El primer autor, Dusan Kolarski (fila de atrás, a la izquierda), con el equipo del Instituto de Biomoléculas Transformativas de la Universidad de Nagoya (Japón), incluidos los coautores Tsuyoshi Hirota (fila de atrás, en el centro), Akiko Sugiyama (delante, segunda por la izquierda) y Yoshiko Nagai (delante, cuarta por la izquierda).
Junto con sus colegas japoneses de la Universidad de Nagoya, los científicos de la Universidad de Groningen demostraron cómo el ciclo de las células cultivadas se prolongaba de 24 a 28 horas mediante el tratamiento con el derivado del longdaysin.
La desactivación con luz verde devolvió el ciclo a algo más de 25 horas y la posterior reactivación con luz violeta lo devolvió a 28 horas.
Los científicos también ajustaron la fase de los ciclos en las células cultivadas:
Es como si las células estuvieran sincronizadas con una zona horaria diferente.
Los experimentos son una prueba de principio y permitirán a los científicos estudiar el reloj circadiano con mucho más detalle. El siguiente paso sería utilizar la longdaysin en animales.
Kolarski:
En realidad podemos llegar a bastantes órganos con la luz, por ejemplo con un endoscopio.
También hay varias opciones emergentes para generar luz dentro de los órganos o tejidos, mediante técnicas como la bioluminiscencia o la sono-luminiscencia.
Aunque estos niveles de luz están todavía varios órdenes de magnitud por debajo de lo que necesitamos para accionar un interruptor.
Trabajaremos duro para aumentar la sensibilidad en los próximos años, subrayan tanto Szymanski como Feringa.
Kolarski añade:
|